碳化硅的结构

碳化硅是由碳原子和硅原子以共价键为主相结合而构成的化合物。共价键是四种基本的键型(离子键、共价键、金属键、分子键)中结合力最强的一种,再加上碳原子与硅原子相互作用成键时,发生了电子在壳层上的转移,形成了键能更为坚强的SP3杂化轨道,这就是碳化硅形成类金刚石的结构、具有很高的硬度和熔点的原因。
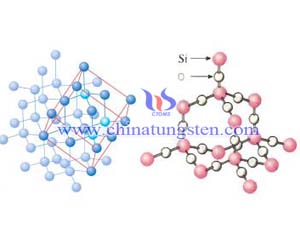
碳原子的电子层结构是C,1s22s22p2,即它的外层电子有四个,其中两个是2s电子,两个是2p电子。2s次层只有一个轨道,这两个2s电子都在这个轨道上,惟自旋相反。2p次层可以有三个轨道,分别记为2px、2py、2pz。所以碳原子的外层有四个轨道,即2s。2px,2py、2pz。电子在这四种轨道上运动时,2s轨道的电子云分布式球形对称,2p轨道有点像哑铃形状。2px2py2pz的形状一样,只是分布的方向不同,它们分别顺着x、y、z、三轴的方向分布。 就有四个未成对的价电子,与外界可以形成四个共价键。2S电子激发到2Pz轨道虽然要花费能量,但这样可以形成两个共价键,可以得到更多的结构。这就说明了为什么碳原子可以是四个共价键。碳原子中的四个价电子,有一个2s电子式球形对称的,另外三个2p电子是互相垂直的。当这四个价电子与外界联系形成四个共价键时,是否有三个共价键是互相垂直的,而另一个是任意方向的呐?事实上不是这样的。
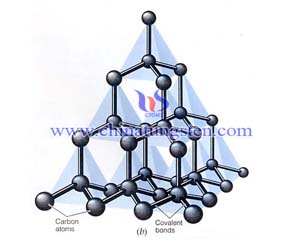
理论和时间都可以说明,当C原子与外界形成四个共价键时它外层的四个轨道(2S,2Px,2Py,2Pz)要互相混合重新组成四个等同的新轨道,称为杂化轨道sp3。这四个杂化轨道的方向是指向正四面体的四角,其电子云分布式集中在四面体中心与四个顶角之间,分成四个相同的分支。这样的杂化轨道称为四面体杂化轨道,与外界时,要尽可能按四面体的结构来成键。碳化硅是由碳原子和硅原子以共价键为主相结合而构成的化合物。共价键是四种基本的键型(离子键、共价键、金属键、分子键)中结合力最强的一种,再加上碳原子与硅原子相互作用成键时,发生了电子在壳层上的转移,形成了键能更为坚强的SP3杂化轨道,这就是碳化硅形成类金刚石的结构、具有很高的硬度和熔点的原因。
碳原子的电子层结构是C,1s22s22p2,即它的外层电子有四个,其中两个是2s电子,两个是2p电子。2s次层只有一个轨道,这两个2s电子都在这个轨道上,惟自旋相反。2p次层可以有三个轨道,分别记为2px、2py、2pz。所以碳原子的外层有四个轨道,即2s。2px,2py、2pz。电子在这四种轨道上运动时,2s轨道的电子云分布式球形对称,2p轨道有点像哑铃形状。2px2py2pz的形状一样,只是分布的方向不同,它们分别顺着x、y、z、三轴的方向分布。 就有四个未成对的价电子,与外界可以形成四个共价键。2S电子激发到2Pz轨道虽然要花费能量,但这样可以形成两个共价键,可以得到更多的结构。这就说明了为什么碳原子可以是四个共价键。碳原子中的四个价电子,有一个2s电子式球形对称的,另外三个2p电子是互相垂直的。当这四个价电子与外界联系形成四个共价键时,是否有三个共价键是互相垂直的,而另一个是任意方向的呐?事实上不是这样的。理论和时间都可以说明,当C原子与外界形成四个共价键时,它外层的四个轨道(2S,2Px,2Py,2Pz)要互相混合重新组成四个等同的新轨道,称为杂化轨道sp3。这四个杂化轨道的方向是指向正四面体的四角,其电子云分布式集中在四面体中心与四个顶角之间,分成四个相同的分支。这样的杂化轨道称为四面体杂化轨道,与外界时,要尽可能按四面体的结构来成键。





